Focus sulla malnutrizione in età pediatrica e perinatale, strategie di prevenzione e trattamento
Tempo di lettura: 13,2 min.
Introduzione
Dati recenti indicano che al mondo ci sono attualmente quasi due miliardi di persone con carenze di micronutrienti, quali vitamine e minerali (1). Un rischio maggiore di incorrere in questo tipo di carenze nutrizionali è stato riscontrato prevalentemente nelle donne in stato di gravidanza e nella popolazione pediatrica, soprattutto nei paesi a basso e medio reddito (in inglese low-to-middle income countries o LMIC) (2). Le carenze di micronutrienti possono risultare da diete che cronicamente mancano di diversità e quindi non forniscono quantità sufficienti di vitamine e minerali essenziali per soddisfare le raccomandazioni giornaliere consigliate oppure a seguito di infezioni e/o malattie croniche che possono contribuire alle carenze di micronutrienti inibendo direttamente l’assorbimento degli stessi (2,3). A causa dell’aumento dei requisiti nutrizionali durante la gravidanza o nei bambini in fase di crescita, le carenze di micronutrienti sono spesso esacerbate in questi periodi (3).
Inquadramento epidemiologico
Secondo alcune stime, la prevalenza globale dell’anemia da carenza di ferro prenatale è del 19,2%, mentre la carenza di vitamina A colpisce il 15,3% delle donne in gravidanza (4). Inoltre, si stima che il 43% dei bambini al di sotto dei cinque anni abbia l’anemia (5), il 29% dei bambini nei LMIC sia carente di vitamina A (6), il 30% dei bambini in età scolare abbia un’assunzione insufficiente di iodio (7) e il 17% della popolazione globale sia carente di zinco (8). Di fatto, questo tipo di malnutrizione è associata ad una serie di esiti avversi per la madre e in particolare per il bambino, in quanto può avere diverse conseguenze sia immediate che a lungo termine per lo sviluppo fisiologico e la salute del bambino (9). La carenza di iodio nell’infanzia è stata inoltre dimostrata essere un fattore di rischio per il ritardo nello sviluppo (10). Similmente, la carenza di zinco è stata collegata a una crescita compromessa e a una funzione immunitaria depressa, risultando in ritardo nella crescita, deperimento e infezioni gravi (11). L’anemia da carenza di ferro nell’infanzia e nei primi anni di vita è stata, invece, associata a uno scarso sviluppo motorio e a difetti cognitivi irreversibili che compromettono l’apprendimento e riducono il livello di istruzione (12,13), mentre una carenza da vitamina A aumenta il rischio di cecità e di morte per condizioni comuni nei bambini come diarrea e morbillo (14).
In uno studio epidemiologico del 2011 è stato stimato che la malnutrizione, che in generale comprende le carenze di micronutrienti, il ritardo nella crescita e il deperimento, abbia provocato nei LMIC 3,1 milioni di morti infantili all’anno e circa il 45% di tutti i decessi in età pediatrica nello stesso anno (4). A distanza di 10 anni, su scala globale, si è stimato che circa 149 milioni di individui sotto i cinque anni presentassero arresto della crescita e 45 milioni fossero denutriti (15). Bisogna però tenere presente che valutare lo stato dei micronutrienti nei bambini al di sotto dei cinque anni è una sfida, specialmente nei LMIC, a causa dell’aggregazione inappropriata dei dati a livello nazionale e della mancanza di risorse, definizioni e strumenti coerenti per misurare lo stato nutrizionale nei LMIC. Per questi motivi, le stime riportate si accompagnano ad un notevole grado di incertezza.
Strategie di prevenzione e trattamento
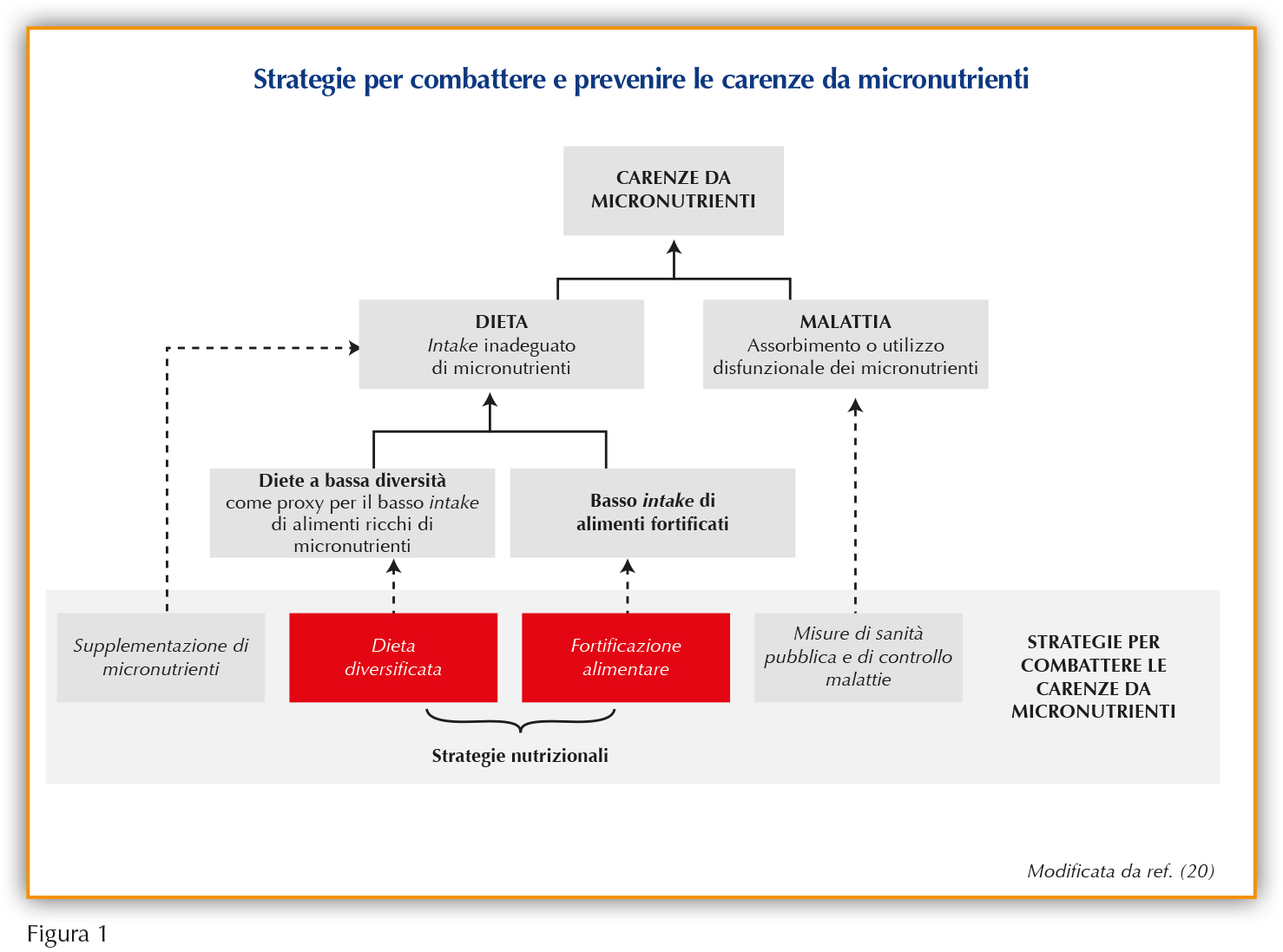
La migliore strategia per mantenere un apporto nutrizionale completo e prevenire carenze nutrizionali di qualsiasi tipo rimane quella di una dieta equilibrata, associata a uno stile di vita sano, specialmente durante la crescita (16). Naturalmente, lo stato nutrizionale del bambino dipende da molti fattori che, molto spesso, ostacolano l’adesione a uno schema dietetico salutare (e.g. livello educativo ed economico della famiglia, reperibilità di alimenti freschi di stagione, eventuali patologie ed interazioni tra farmaci e alimenti) (17). Succede spesso che gli studi clinici in materia non tengano conto delle differenze nell’accesso a una nutrizione adeguata dei bambini provenienti da diversi Paesi. Possono infatti esserci differenze significative nei deficit di micronutrienti o vitamine tra Paesi a basso e ad alto reddito; tuttavia, uno sguardo più attento all’Europa rivela che, anche in una società ricca di risorse con libero accesso a qualsiasi tipo di alimento, può essere difficile per alcuni raggiungere un apporto vitaminico adeguato (18,19). Perciò, sono state sviluppate diverse strategie ad hoc per combattere e prevenire la malnutrizione, con l’obiettivo finale di migliorare lo stato di salute dei bambini malnutriti o con specifiche carenze. Queste strategie comprendono la supplementazione di singoli o multipli micronutrienti, la supplementazione con nutrienti a base lipidica e la fortificazione che può essere mirata, su larga scala o sul luogo d’uso, con polvere di micronutrienti (Figura 1) (20).
Diversi studi hanno riportato gli effetti della supplementazione di micronutrienti sulla salute dei bambini nei Paesi a basso e medio reddito. Per esempio, la supplementazione di vitamina A, analizzata in una recente metanalisi di 19 studi clinici randomizzati, ha comportato una riduzione del 10% del rischio di mortalità (rischio relativo (RR) 0.90, 95% CI: 0.80 to 1.02) (21). La supplementazione di zinco è stata, invece, associata a una riduzione del 10% nei tassi di diarrea (RR 0.89, 95% CI 0.82 – 0.97) e a una diminuzione del 63% nel rischio di carenza di zinco (RR 0.37, 95% CI: 0.22 – 0.62); la supplementazione di ferro ha invece migliorato significativamente gli indicatori del metabolismo del ferro e ha mostrato miglioramenti anche nei punteggi dello sviluppo mentale (differenza media standardizzata (SMD) 0.14, 95% CI: 0.01 – 0.28) e motorio (SMD 0.28, 95% CI: 0.15 – 0.40) e, in associazione con acido folico, ha ridotto l’incidenza di anemia del 20% (RR 0.80, 95% CI 0.66 – 0.97) pur non avendo alcun impatto sulla diarrea (21). Le linee guida dell’OMS raccomandano l’integrazione giornaliera di ferro nei bambini sotto i cinque anni in popolazioni in cui la prevalenza dell’anemia è del 40% o superiore (22). Tuttavia, il ferro per via orale non deve essere somministrato ai bambini che vivono in zone endemiche per la malaria, dove monitoraggio e misure di prevenzione/gestione appropriate per la malaria non sono disponibili (22).
Le polveri di micronutrienti hanno ridotto del 24% il rischio di anemia. Tuttavia, è stato riportato un aumento del 30% del rischio di diarrea (21). Al contrario, la supplementazione di micronutrienti sotto altre forme non ha aumentato il rischio di diarrea e ha mostrato miglioramenti in vari indicatori di salute. La supplementazione con micronutrienti multipli o MMN è stata associata a un ridotto rischio di anemia (RR 0,69, 95% CI: 0,56 – 0,85), soprattutto tra i bambini che hanno assunto la supplementazione con MMN quotidianamente rispetto a quelli che l’hanno assunta in modo intermittente (21). Sono state osservate differenze significative anche per regione, con una maggiore riduzione del rischio di anemia tra i bambini nelle Americhe, nel Pacifico occidentale e in Africa, rispetto al sudest asiatico, anche se le dimensioni del campione non erano distribuite in modo uniforme tra le regioni (21). La supplementazione con MMN è stata associata ad un miglioramento della crescita in altezza (MD 0,36 cm, 95% CI: 0,01 – 0,71), concentrazione di emoglobina (MD 4,40 g/L, 95% CI: 2,91 – 5,90), di ferritina plasmatica/sierica (MD 12,55 μg/L, 95% CI: 3,93 – 21,27), di retinolo plasmatico/sierico (MD 0,11 μmol/L, 95% CI: 0,07 – 0,16), e di zinco plasmatico/sierico (MD 0,95 μmol/L, 95% CI: 0,23 – 1,67) (21). Inoltre, tale supplementazione ha portato ad una diminuzione della concentrazione del recettore transferrinico solubile (MD -0,19 mg/L log, 95% CI: -0,30 – -0,09) e del rischio di carenza di ferro (RR 0,41, 95% CI: 0,25 – 0,66) (21).
Gli integratori alimentari a base lipidica (LNS), invece, hanno portato ad un forte miglioramento di outcomes primari quali incidenza di anemia (RR 0.84, 95% CI 0.75 – 0.93), ritardo della crescita (RR 0.90, 95% CI 0.84 – 0.96) e numero di bambini sottopeso (RR 0.90, 95% CI 0.81 – 1.01) (21). Esaminando l’efficacia di questo intervento, diversi studi hanno riscontrato risultati simili per quanto riguarda l’anemia e gli z-score relativi alla lunghezza per età (MD 0.11, 95% CI 0.05 – 0.15), al peso per età (MD 0.10, 95% CI 0.04 – 0.17) e per altezza (MD 0.09, 95% CI 0.04 – 0.16), sottolineando l’utilità di questo intervento per programmi preventivi basati sulla comunità. Gli studi sull’efficacia hanno anche evidenziato alcuni effetti positivi degli LNS sugli esiti dello sviluppo mentale (SMD 0.13, 95% CI 0.02 – 0.23) e motorio (SMD 0.13, 95% CI 0.00 – 0.25), mettendo in luce il legame tra la nutrizione precoce e lo sviluppo (21).
Supplementazione con sostanze ad azione nutraceutica
Seppur l’intake alimentare fosse potenzialmente sufficiente per una condizione di salute standard, la supplementazione può consentire il miglioramento di indici di salute specifici. Diverse sostanze ad azione nutraceutica sono state studiate per il loro possibile impatto positivo sui livelli lipidici e sulla salute cardiovascolare (23). Ad esempio, la fibra alimentare, componente di alimenti di origine vegetale che comprende carboidrati complessi indigeribili, come polisaccaridi non amidacei (cellulosa, emicellulosa, gomme, pectine, crusca d’avena e di frumento), oligosaccaridi (inulina, frutto-oligosaccaridi) e lignina (una sostanza non glucidica legata alla fibra), ha dimostrato un’efficacia sul metabolismo lipidico andando a ridurre i livelli di colesterolo totale (CT) e di lipoproteine a bassa densità (LDL-C) (24). L’effetto ipolipemizzante della fibra dipende dalle sue proprietà chimico-fisiche e dalla viscosità. La fibra insolubile e non fermentabile (come la lignina) aumenta la massa fecale con effetto lassativo (25). Le fibre solubili, non viscose e fermentabili (come inulina, destrina, oligosaccaridi) favoriscono la sintesi di acidi grassi a catena corta, come acetato, butirrato e propionato, associato all’inibizione della sintesi del colesterolo (25). Inoltre, alcuni tipi di fibra alimentare, sia solubili che insolubili, rallentano lo svuotamento gastrico e riducono l’assorbimento dei nutrienti (25). Anche i probiotici, inibiscono l’assorbimento intestinale di colesterolo, e favoriscono l’idrolisi dei sali biliari con conseguente riduzione dei livelli circolanti di LDL-C e apolipoproteina B (Apo-B) (25). La somministrazione di ceppi selezionati di Bifidobatterium ha migliorato il profilo lipidico in bambini dislipidemici (26).
Il riso rosso fermentato, ottenuto dalla fermentazione del riso con il micete Monascus purpureus, contiene la Monacolina K, una molecola con effetto statino-simile di inibizione dell’enzima chiave nella sintesi del colesterolo (23). È stato dimostrato che l’assunzione di riso rosso fermentato, in concomitanza ad un regime dietetico controllato, diminuisce i livelli di CT, LDL-C e Apo-B in una popolazione pediatrica ad elevato rischio cardiovascolare (27). Inoltre, le proteine della soia contengono isoflavoni, che possono influire positivamente sui recettori LDL epatici (25). La somministrazione di latte di soia in regime dietetico controllato ha ridotto i livelli sierici di CT, LDL-C e Apo-B in bambini con ipercolesterolemia familiare (28). Anche gli acidi grassi polinsaturi (PUFA) sono noti per la loro azione sul profilo lipidico e sui marker di rischio cardiovascolare. La somministrazione giornaliera di latte arricchito con PUFA e a basso contenuto di acidi grassi saturi ha ridotto le concentrazioni di molecole legate all’infiammazione e all’adesione cellulare in 107 bambini sani (25). Una delle fonti più ottimali di PUFA è l’olio di canapa, ricco di Omega-3 (acido α-linolenico) e Omega-6 (acido linoleico) in un rapporto equilibrato (25). Infine, la frutta secca che contiene acidi grassi monoinsaturi, PUFA, fitosteroli, antiossidanti, vitamine, fibre e polifenoli aiuta nel ridurre i livelli di LDL-C, e aumenta il rapporto HDL-C/LDL-C, oltre ad avere proprietà antiossidanti, e a modulare il microbioma intestinale (29,30).
Queste e tante altre sostanze ad azione nutraceutica sono state oggetto di approfonditi studi per valutarne l’efficacia nel migliorare il profilo lipidico e promuovere la salute cardiovascolare, con risultati promettenti. Tuttavia, è fondamentale evidenziare che l’uso di tali integratori deve essere attentamente valutato, tenendo conto delle caratteristiche individuali e sotto la supervisione di professionisti della salute adeguatamente formati. In aggiunta, è essenziale sottolineare la necessità di considerare il contesto nell’attuazione degli interventi di integrazione alimentare. Diverse strategie hanno dimostrato efficacia nel trattare specifici esiti di salute, suggerendo che una combinazione di interventi potrebbe essere necessaria. Tuttavia, nell’implementare tali strategie, è cruciale valutare fattori come il costo, la fattibilità, la capacità di monitoraggio e le questioni specifiche della popolazione per garantire un’attuazione di successo.
Bibliografia
1. Development Initiatives. Global Nutrition Report 2018: Shining a light to spur action on nutrition. Bristol; 2018.
2. FAO and WHO. Vitamin and mineral requirements in human nutrition. In: Joint FAO/WHO Expert Consultation on Human Vitamin and Mineral Requirements. Second edition. Geneva: World Health Organization; 2004.
3. Bailey RL, West KP, Black RE. The epidemiology of global micronutrient deficiencies. Ann Nutr Metab. 2015;66 Suppl 2:22–33.
4. Black RE, Victora CG, Walker SP, Bhutta ZA, Christian P, de Onis M, et al. Maternal and child undernutrition and overweight in low-income and middle-income countries. Lancet. 2013 Aug 3;382(9890):427–51.
5. Stevens GA, Finucane MM, De-Regil LM, Paciorek CJ, Flaxman SR, Branca F, et al. Global, regional, and national trends in haemoglobin concentration and prevalence of total and severe anaemia in children and pregnant and non-pregnant women for 1995-2011: a systematic analysis of population-representative data. Lancet Glob Health. 2013 Jul;1(1):e16-25.
6. Stevens GA, Bennett JE, Hennocq Q, Lu Y, De-Regil LM, Rogers L, et al. Trends and mortality effects of vitamin A deficiency in children in 138 low-income and middle-income countries between 1991 and 2013: a pooled analysis of population-based surveys. Lancet Glob Health. 2015 Sep;3(9):e528–36.
7. Andersson M, Karumbunathan V, Zimmermann MB. Global iodine status in 2011 and trends over the past decade. J Nutr. 2012 Apr;142(4):744–50.
8. Wessells KR, Brown KH. Estimating the global prevalence of zinc deficiency: results based on zinc availability in national food supplies and the prevalence of stunting. PLoS One. 2012;7(11):e50568.
9. Gernand AD, Schulze KJ, Stewart CP, West KP, Christian P. Micronutrient deficiencies in pregnancy worldwide: health effects and prevention. Nat Rev Endocrinol. 2016 May;12(5):274–89.
10. Walker SP, Wachs TD, Grantham-McGregor S, Black MM, Nelson CA, Huffman SL, et al. Inequality in early childhood: risk and protective factors for early child development. Lancet. 2011 Oct 8;378(9799):1325–38.
11. Imdad A, Rogner J, Sherwani RN, Sidhu J, Regan A, Haykal MR, et al. Zinc supplementation for preventing mortality, morbidity, and growth failure in children aged 6 months to 12 years. Cochrane Database Syst Rev. 2023 Mar 30;3(3):CD009384.
12. Lozoff B. Iron deficiency and child development. Food Nutr Bull. 2007 Dec;28(4 Suppl):S560-71.
13. Christian P. Prenatal Micronutrient Supplementation and Intellectual and Motor Function in Early School-aged Children in Nepal. JAMA. 2010 Dec 22;304(24):2716.
14. Imdad A, Mayo-Wilson E, Herzer K, Bhutta ZA. Vitamin A supplementation for preventing morbidity and mortality in children from six months to five years of age. Cochrane Database of Systematic Reviews. 2017 Mar 10;2017(11).
15. World Health Organization. Malnutrition [Internet]. 2021 May [cited 2023 Dec 14]. Available from: https://www.who.int/news-room/fact-sheets/detail/malnutrition
16. Bailey RL, Gahche JJ, Thomas PR, Dwyer JT. Why US children use dietary supplements. Pediatr Res. 2013 Dec 3;74(6):737–41.
17. Cicero AFG, Fogacci F. La prescrizione della “dieta sana”: come è cambiato il paradigma negli ultimi 30 anni. Medicina e Salute. 2023;2:147–9.
18. Kaganov B, Caroli M, Mazur A, Singhal A, Vania A. Suboptimal Micronutrient Intake among Children in Europe. Nutrients. 2015 May 13;7(5):3524–35.
19. SINU (Società Italiana di Nutrizione Umana), VITAMINE – Fabbisogno medio (AR), MINERALI – Fabbisogno medio (AR). Tabelle LARN 2014. 2014.
20. Bechoff A, de Bruyn J, Alpha A, Wieringa F, Greffeuille V. Exploring the Complementarity of Fortification and Dietary Diversification to Combat Micronutrient Deficiencies: A Scoping Review. Curr Dev Nutr. 2023 Feb;7(2):100033.
21. Tam E, Keats EC, Rind F, Das JK, Bhutta ZA. Micronutrient Supplementation and Fortification Interventions on Health and Development Outcomes among Children Under-Five in Low- and Middle-Income Countries: A Systematic Review and Meta-Analysis. Nutrients. 2020 Jan 21;12(2):289.
22. WHO. Guideline: Daily Iron Supplementation in Infants and Children; World Health Organization: Geneva, Swiztherland, 2016.
23. Cicero AFG, Fogacci F, Stoian AP, Vrablik M, Al Rasadi K, Banach M, et al. Nutraceuticals in the Management of Dyslipidemia: Which, When, and for Whom? Could Nutraceuticals Help Low-Risk Individuals with Non-optimal Lipid Levels? Curr Atheroscler Rep. 2021 Oct 4;23(10):57.
24. Giacco R, Clemente G, Cipriano D, Luongo D, Viscovo D, Patti L, et al. Effects of the regular consumption of wholemeal wheat foods on cardiovascular risk factors in healthy people. Nutrition, Metabolism and Cardiovascular Diseases. 2010 Mar;20(3):186–94.
25. Massini G, Buganza R, De Sanctis L, Guardamagna O. La nutraceutica nel bambino dislipidemico. Giornale Italiano dell’Arteriosclerosi 2019; 10 (4): 32-48.
26. Guardamagna O, Amaretti A, Puddu PE, Raimondi S, Abello F, Cagliero P, et al. Bifidobacteria supplementation: Effects on plasma lipid profiles in dyslipidemic children. Nutrition. 2014 Jul;30(7–8):831–6.
27. Guardamagna O, Abello F, Baracco V, Stasiowska B, Martino F. The treatment of hypercholesterolemic children: Efficacy and safety of a combination of red yeast rice extract and policosanols. Nutrition, Metabolism and Cardiovascular Diseases. 2011 Jun;21(6):424–9.
28. Weghuber D, Widhalm K. Effect of 3-month treatment of children and adolescents with familial and polygenic hypercholesterolaemia with a soya-substituted diet. British Journal of Nutrition. 2008 Feb 1;99(2):281–6.
29. Guaraldi F, Deon V, Del Bo’ C, Vendrame S, Porrini M, Riso P, et al. Effect of short-term hazelnut consumption on DNA damage and oxidized LDL in children and adolescents with primary hyperlipidemia: a randomized controlled trial. J Nutr Biochem. 2018 Jul;57:206–11.
30. Gargari G, Deon V, Taverniti V, Gardana C, Denina M, Riso P, et al. Evidence of dysbiosis in the intestinal microbial ecosystem of children and adolescents with primary hyperlipidemia and the potential role of regular hazelnut intake. FEMS Microbiol Ecol. 2018 May 1;94(5).
Articolo pubblicato su Riflessioni Universo Pediatria Approfondimenti
Articoli collegati
Introduzione L’endometriosi è un disturbo ginecologico caratterizzato dalla presenza di cellule endometriali e stroma al di fuori del rivestimento uterino. È la principale causa patologica di dismenorrea e dolore pelvico cronico tra le adolescenti (1), il cui quadro clinico può presentare differenze significative rispetto a quello osservato nelle donne adulte, con possibile ritardo nella diagnosi [...]
La febbre di origine sconosciuta (FUO) rappresenta una sfida diagnostica significativa per i professionisti della salute. Questa condizione, caratterizzata da un aumento persistente della temperatura corporea (≥ 38°C per una durata ≥ 7-14 giorni) senza una chiara causa identificata (1), richiede un approccio diagnostico mirato e specifico. La FUO è stata suddivisa in quattro sottoclassi [...]
Le malattie autoinfiammatorie, sebbene relativamente rare nei bambini, rappresentano spesso una sfida diagnostica e vengono frequentemente considerate come possibili cause di episodi febbrili di origine sconosciuta. Queste malattie sono caratterizzate da una varietà di sintomi, tra cui febbre, infiammazione, dolore articolare e muscolare, rash cutanei e disturbi gastrointestinali. Questi sintomi possono essere simili a quelli [...]